
Size-dependent cellular uptake and sustained drug release of PLGA particles (Open Access)
孙锐,刘霞,张瑜*,李茜,诸颖,樊春海*
Keywords: DEX-loaded PLGA particles (DPs); Sustained release; Anti-inflammatory efficacy
DOI: 10.1016/j.partic.2022.03.003
聚乳酸-羟基乙酸共聚物(PLGA)是一种常用的生物可降解聚合物。由于其在生物相容性、载药和药物控释方面诸多优越性能,在药物递送系统的开发中备受关注。将水不溶性药物包封到PLGA颗粒中缓慢释放是其很重要的应用之一,在制药工业中被广泛使用。目前,医药市场上已有数款被美国FDA批准用于临床的PLGA产品。
PLGA的粒径大小是其在细胞摄取和药物缓释中的重要参数。在过去二十年中,研究者们已经开展了一系列粒径与生物效应的研究工作。然而,粒径范围从200 nm到2 μm的PLGA颗粒的药物包封效率、细胞摄取和持续释放效应的系统比较的工作未见报道。为此,上海交通大学樊春海院士团队在Particuology上发表研究文章,系统研究了PLGA颗粒粒径依赖的细胞生物学效应。该文章合成了平均粒径分别为200、500和2000 nm的PLGA颗粒,以具有优异抗炎特性的地塞米松(DEX)为模型药物,制备了负载DEX的PLGA颗粒(DPs),研究了不同粒径DPs的药物包封率、细胞摄取和体外药物释放行为。另外,该文章中的药效学评估显示,在脂多糖(LPS)诱导的RAW 264.7细胞模型中,500 nm DPs显示出持续的抗炎功效。相关工作为设计基于PLGA颗粒的药物输送系统用于进一步的生物医学研究提供了重要信息。
本文已OA,欢迎感兴趣的读者扫描下方二维码进入ScienceDirect官网阅读、下载!

01 不同粒径DPs的制备及表征
本文作者首先利用水包油乳液溶剂蒸发技术(图1(a))制备了三种不同粒径的DPs颗粒,并通过调整超声处理时间来控制颗粒粒径。SEM图像显示所有DPs为球形,大小较均一,表面光滑。动态光散射(DLS)分析表明,三种DPs的水合粒径分别为207、510、1980 nm,zeta电位值分别为–14.0、–13.8、–14.2 mV(图1(b))。紫外吸收光谱分析表明,三种DPs在240 nm处具有明显的DEX特征吸收峰(图1(c))。综上表明,作者成功地制备了三种不同大小的DPs。HPLC法测定了不同大小DPs中的DEX含量,发现DEX在200、500、2000 nm DPs中的包封率分别为20%、30%、53%(图1(d))。2000 nm DPs的载药量分别是200和500 nm DPs的2.7倍和1.7倍,表明微米DPs的载药量高于亚微米DPs。
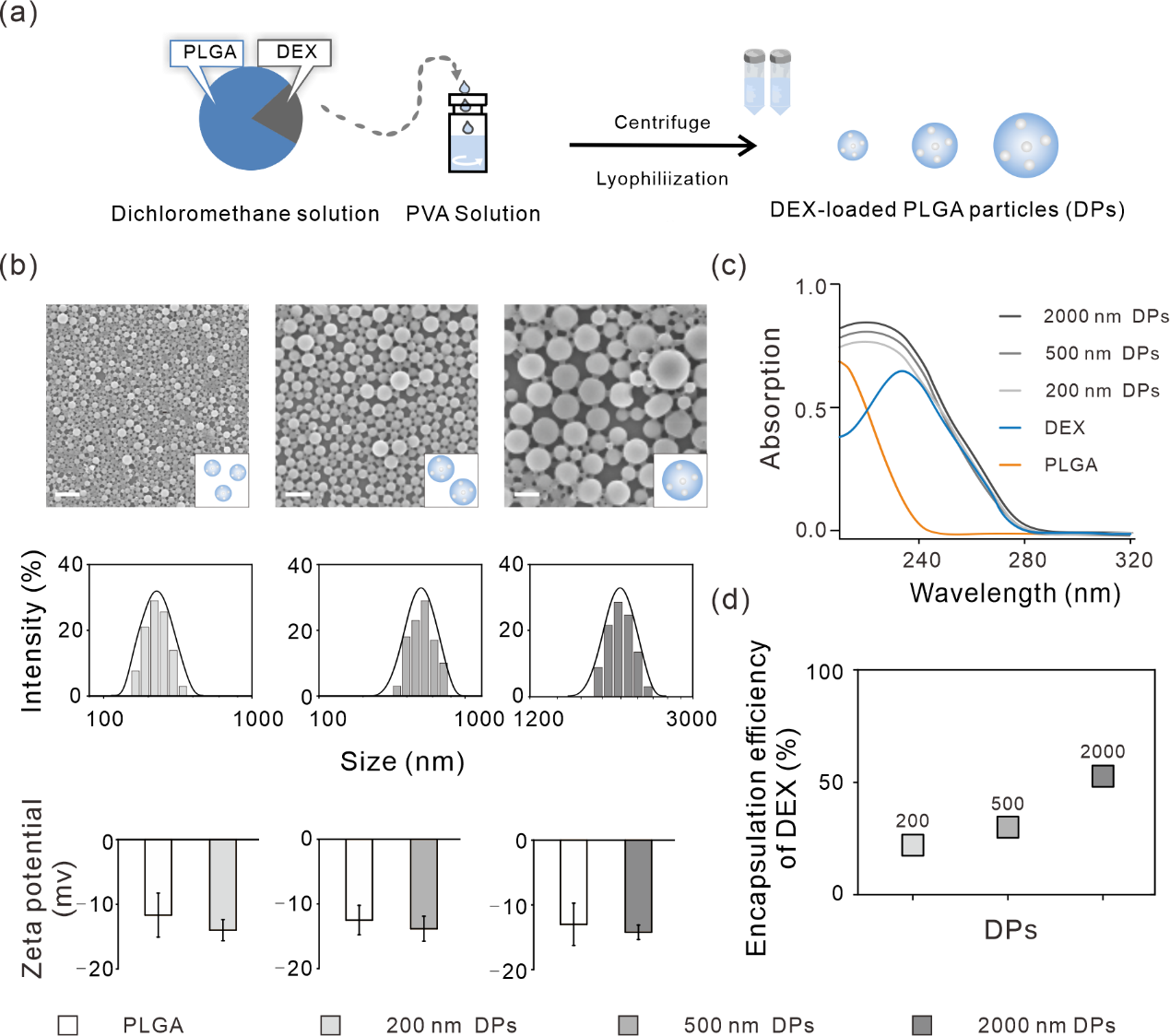
图1. 不同粒径DPs的制备和表征。(a)水包油(o/w)乳液溶剂蒸发法制备DPs示意图。(b)上:DPs的SEM图,比例尺:2 µm;中:DPs的粒径分布;下:DPs的zeta电位。(c)三种粒径DPs、DEX和PLGA的紫外吸收光谱图。(d)不同粒径DPs中DEX的包封率。
02 DPs和细胞的相互作用
为了追踪细胞中不同大小DPs的细胞摄取过程,作者采用相似粒径的荧光小球(FluoSpheres)代替DPs,将Raw 264.7细胞与不同粒径的荧光小球一起孵育,并使用DV Elite实时活细胞成像显微镜观察其与细胞的相互作用。作者发现200、500和2000 nm的绿色荧光小球分别沿着细胞膜移动,膜上移动时间分别为20、15和40秒,然后穿过细胞膜进入细胞质。200、500和2000 nm颗粒在细胞膜上和细胞内的移动速度分别为0.04、0.05、0.06 μm/s和0.23、0.20、0.13 μm/s(图2(a))。虽然这些颗粒在细胞膜上和细胞内的移动速度基本相同,但微米颗粒在细胞膜上的停留时间较长,说明亚微米粒子更容易被细胞摄取。细胞荧光成像结果显示,最佳孵育时长(12小时)下细胞内200、500和2000 nm颗粒的平均荧光强度(MFI)分别为34、31和9(图2(b)),进一步证明亚微米颗粒更容易被细胞摄取。
03 DPs介导DEX在RAW 264.7细胞中的释放
作者研究了不同大小的DPs对DEX递送的影响。DPs与细胞孵育12小时后,通过HPLC测得200、500和2000 nm DPs处理组的细胞内平均DEX量分别为315、279和68 ng。与使用相同量的游离DEX处理相比,三种粒径DPs孵育的细胞中DEX浓度分别提高了31.5、27.9和6.8倍(图2(c))。如前所述,作者发现微米级DPs中DEX的负载量相对较高(图1(d)),但细胞摄取实验却表明微米级DPs细胞摄取量非常低。由于DPs摄取量的高低直接影响药物释放及药效研究,因此在接下来的工作中,作者选择亚微米级颗粒用于进一步研究。
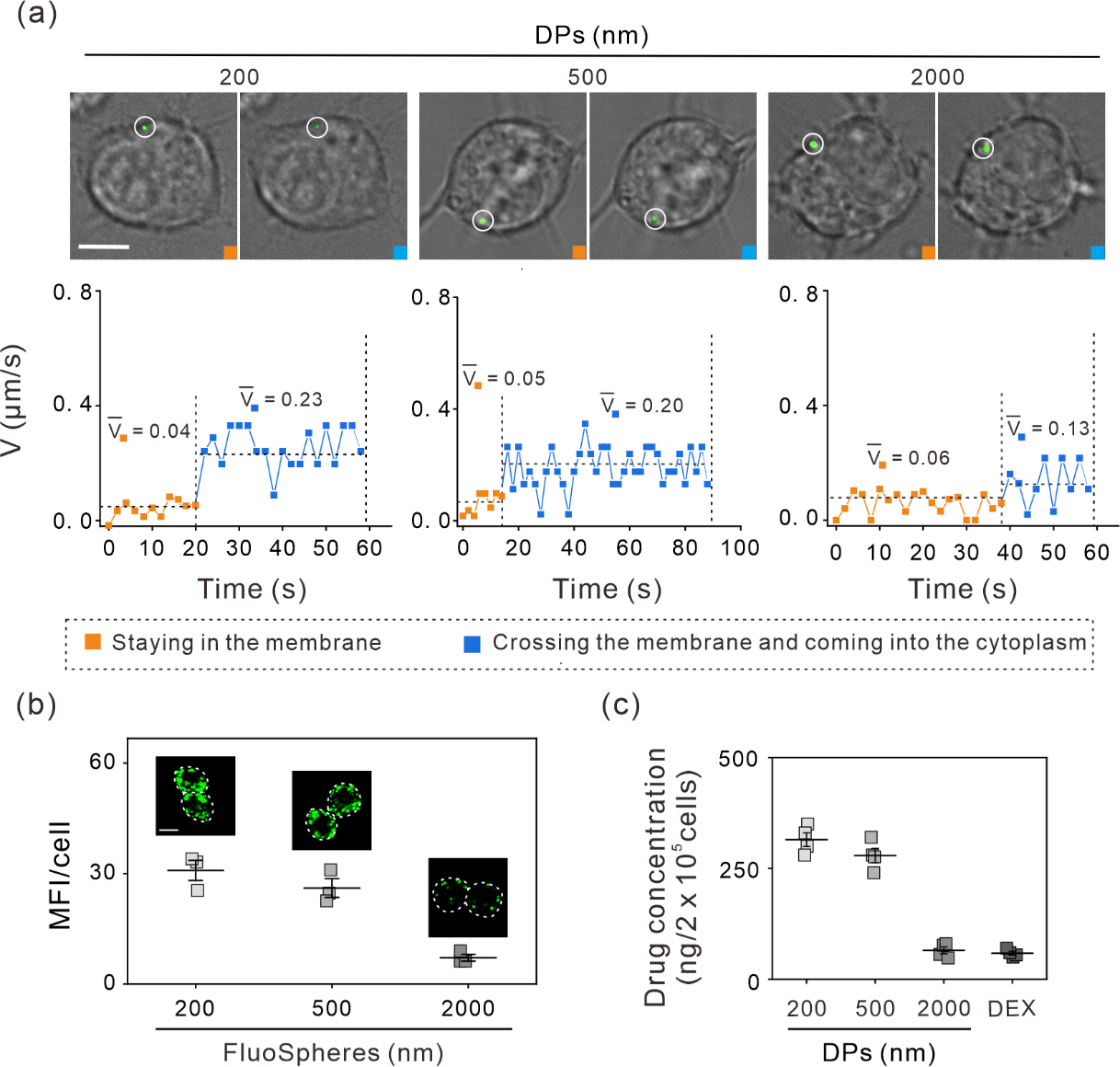
图2. 不同粒径DPs和细胞的相互作用研究。(a)通过DV Elite显微镜观察RAW 264.7细胞对荧光小球的摄取。上:黄色:荧光小球在细胞膜上;蓝色:荧光小球在细胞质内。下:荧光小球在细胞膜上及膜内运动的速度分析。(b)细胞内不同粒径荧光小球的平均荧光强度。将细胞与同DPs相似粒径的三种荧光小球孵育12小时,内化的荧光小球通过共聚焦显微镜成像,比例尺:5 µm。(c)细胞内DEX浓度。RAW 264.7细胞与不同粒径DPs(包封DEX浓度为32 μg/mL)和游离DEX(32 μg/mL)孵育12小时,通过HPLC测量细胞内DEX浓度。
作者研究了DPs在细胞内的清除情况。将DPs与细胞孵育12小时,充分洗去未被内化的DPs,于不同时间点通过HPLC测定细胞中DEX的含量(图3(a))。作者发现细胞内DEX浓度在18小时内缓慢下降。500 nm DPs的细胞内DEX含量在2–12小时内比200 nm DPs要高很多,其含量在2、4、6、12小时分别是200 nm DPs的1.6、2.1、3.0和4.3倍(图3(b)),表明500 nm DPs颗粒的释放更加缓慢。然而,使用游离DEX初始孵育12小时后,细胞内DEX浓度在清除实验的2小时内急剧下降,随后各检测时间点DEX浓度已经降到几乎无法检测的水平。综合考虑,作者选择500 nm的PLGA颗粒进行后续治疗应用研究。
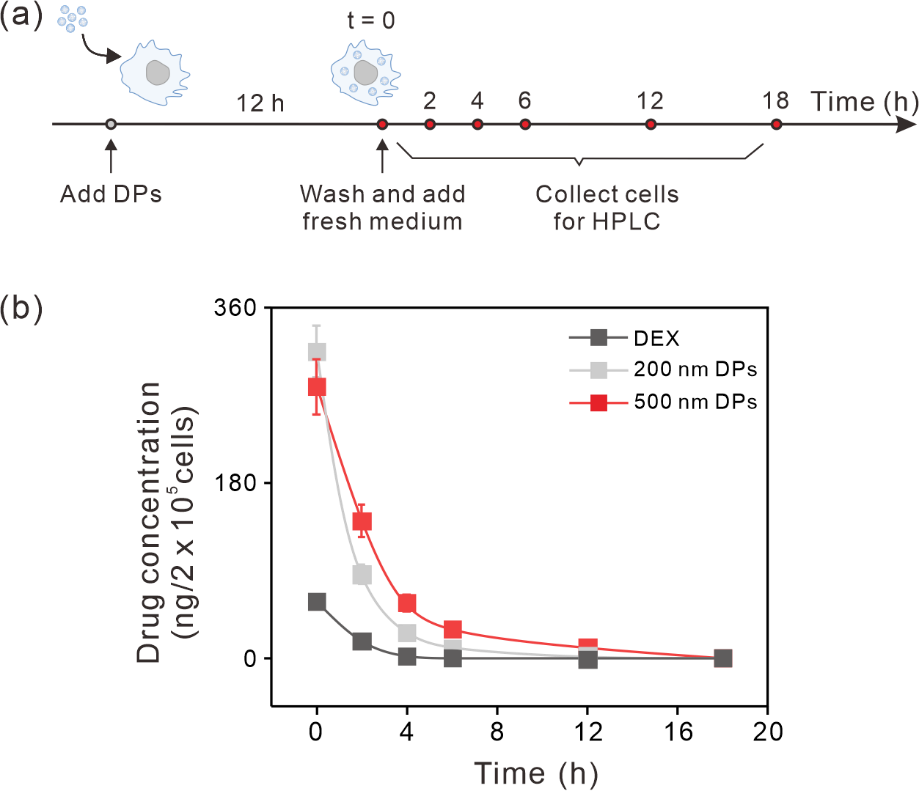
图3. 亚微米级DPs颗粒在RAW 264.7细胞中的持续释放研究。(a)实验设计。(b)细胞内DEX浓度。将细胞分别与200 nm、500 nm DPs(包封DEX浓度为32 μg/mL)和游离DEX(32 μg/mL)孵育12小时,然后加入新鲜培养基继续孵育以研究缓释效应。在指定的时间点收集细胞并通过HPLC分析细胞内DEX浓度。
04 500 nm DPs在细胞炎症模型中的药效评估
用脂多糖(LPS)诱导RAW 264.7建立细胞炎症模型,评估了500 nm DPs对其的疗效。细胞与500 nm DPs(包封DEX浓度为32 μg/mL)或游离DEX(32 μg/mL)孵育2小时,然后加入LPS(1 μg/mL)继续孵育13小时,以诱导巨噬细胞的炎症反应。孵育结束后,ELISA法检测上清液中分泌的炎症因子的浓度(图4(a))。与对照组相比,模型组细胞内炎症因子TNF-α、IL-1β、IL-6和IL-8水平显著升高。DPs或DEX治疗后,与未治疗的模型组相比,细胞内上述炎症因子水平显著降低。DPs治疗组的TNF-α、IL-1β、IL-6和IL-8炎症因子水平(457.5、66.3、207.5、67.8 pg/mL)远低于DEX治疗组(752.5、133.3、331.0、134.0 pg/mL)(图4(b))。彻底清洗DPs后,继续加入新鲜培养基孵育12小时后,细胞中分泌的TNF-α、IL-1β、IL-6和IL-8水平仍然较低,这是由于500 nm DPs持续释放药物DEX的抗炎效果所致(图4(c))。另外,与未治疗的模型组相比,单独PLGA颗粒处理组细胞因子水平没有明显变化,这表明抗炎作用确实是由PLGA释放的DEX产生的。体外生物相容性测试结果显示,500 nm DPs非常安全,即使暴露浓度高达3 μg/mL也未观察到明显毒性。综上可见,基于500 nm 的PLGA治疗递送系统是安全且有效的。
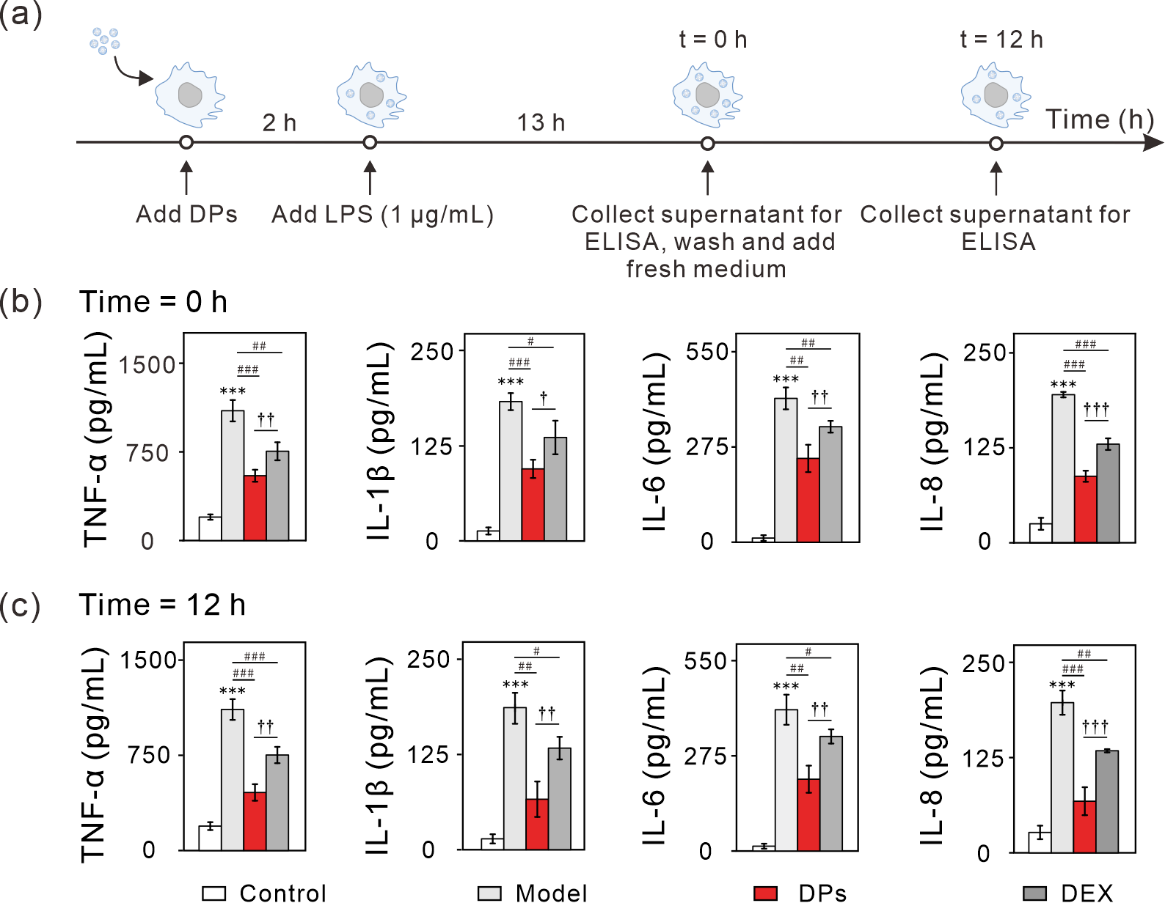
图4. 500 nm DPs在细胞炎症模型中的药效评估。(a)实验设计。(b)500 nm DPs(包封DEX浓度为32 μg/mL)或游离DEX治疗对LPS诱导的Raw 264.7巨噬细胞炎症因子分泌的影响。对照组(正常细胞未做任何处理);模型组(仅用1 μg/mL LPS刺激13小时);500 nm DPs组(用500 nm DPs(包封DEX浓度为32 μg/mL)预孵育2小时,再用1 μg/mL LPS刺激13小时);DEX组(用DEX 32 μg/mL预孵育2小时,再用1 μg/mL LPS刺激13小时)。(c)500 nm DPs或游离DEX对TNF-α、IL-1β、IL-6和IL-8炎症因子的持续抑制作用。通过ELISA分析TNF-α、IL-1β、IL-6和IL-8的表达。***P < 0.001,与对照组显著不同;#P < 0.05,##P < 0.01,###P < 0.001,与模型组显著不同;†P < 0.05,††P < 0.01,†††P < 0.001,与DEX组显著不同。
总结和展望
现有的关于聚合物颗粒粒径对细胞生物学效应的研究工作中,一部分集中于亚微米或微米尺度(粒径小于等于1微米,或者大于等于1微米),另一些则涵盖了从纳米到微米的尺度范围。但是,这些工作大多只关注聚合物的细胞外药物释放或细胞内摄取行为,对影响药物生物效应的诸多因素进行综合评估的研究报道较少。我们知道,基于聚合物的药物递送系统的药效与其载药效率、细胞摄取和释放行为密切相关。在这项工作中,作者研究了200、500和2000 nm三种不同粒径的PLGA颗粒对模型药物DEX的封装效率、PLGA-DEX颗粒的细胞摄取和体外药物释放行为,结果表明,亚微米尺度的500 nm DPs具有最佳的缓释效果。该工作为设计基于PLGA的药物输送系统提供了有用信息。
同时,作者也指出进一步研究的方向,例如研究500 nm附近(300–600 nm粒径范围)的PLGA颗粒的细胞摄取和药物释放行为,以筛选出具有最优药物递送和药物缓释能力的PLGA颗粒粒径。另外,作者还特别指出,不同的药物生物学效应不同,适合的PLGA粒径也不尽相同,因此,未来需要开展更多更全面的生物学实验进行综合评估,以获得适合负载各种药物的最优PLGA粒径。
通讯作者简介

张瑜,中国科学院上海高等研究院副研究员。2018年进入中国科学院上海高等研究院基础交叉中心纳米生物组工作,主要从事纳米材料的设计合成及其在纳米生物安全和癌症治疗方面的研究工作。迄今在Nature Commun.、Adv. Mater.、Nano Today等杂志发表SCI论文10余篇。主持国家自然科学基金项目1项、上海市自然基金项目1项。曾获中科院朱李月华优秀博士生奖(2016)、上海市优秀毕业生(2016)等。

樊春海,中国科学院院士,上海交通大学王宽诚讲席教授、转化医学研究院执行院长、国家转化医学科学中心唐仲英首席科学家。美国科学促进会(AAAS)、国际电化学学会(ISE)、美国医学和生物工程院(AIMBE)和英国皇家化学会(RSC)会士,ACS Applied Materials & Interfaces副主编,以及ChemPlusChem编委会共同主席。在Nature等杂志发表论文500余篇,近七年连续入选“全球高被引科学家”。曾获国家自然科学二等奖(第一完成人),何梁何利基金科学与技术创新奖、美国化学会“测量科学进展讲座奖”、谈家桢生命科学创新奖、药明康德生命化学杰出成就奖、JNBTrailblazer奖等。
供稿:原文作者
编辑:《颗粒学报》编辑部
