
Enzyme–metal nanocomposites for antibacterial applications (Open Access)
熊佳容,蔡辛怡,戈钧*
Keywords: Enzyme–metal nanocomposites; Applications; Preparations; Antibacterial mechanisms
DOI: 10.1016/j.partic.2021.02.003
目前抗生素导致细菌耐药已成为一个世界性的问题,是威胁全球公众健康的主要隐患。因此,开发高效杀菌、环境友好并避免耐药性产生的新型抗菌剂迫在眉睫。近日,清华大学戈钧教授团队在PARTICUOLOGY上发表的综述文章,详细介绍了酶-金属纳米复合制剂的新型制备方法和应用研究前景并深入讨论了酶-金属纳米复合制剂的协同抗菌机制,为新型抗菌剂的创新型开发和针对性改进提供了有效的策略指导。
本文已OA,欢迎感兴趣的读者扫描下方二维码进入Science Direct官网免费阅读、下载!

研究背景
抗生素是全球用于治疗细菌感染性疾病的药物。从上世纪40年代出现以后,抗生素被广泛使用。然而随着抗生素用量的不断增加,其耐药性问题也越来越明显。2017年世界卫生组织在《Global Antimicrobial Resistance Surveillance System (GLASS) Report》中强调抗生素的耐药性是一项世界范围内的挑战。预计到2050年,抗生素耐药性将导致每年1000万人死亡。面对这一挑战,一方面需要通过减少抗生素的用量延缓其耐药性,另一方面亟需开发新型高效、不易产生耐药性的抗菌剂。金属系抗菌剂如银系抗菌剂由于具有抗菌效果好、无刺激性等优点,已被应用于服装、建筑材料、涂料等行业。然而,金属系抗菌剂也存在一些突出问题。首先,有文献报道,金属系抗菌剂仍会存在耐药性;其次,金属纳米颗粒可能会在环境中积累,存在一定的毒性风险;另外,有些金属例如银,存在不稳定的问题,容易沉淀或变色。
为了改进金属系抗菌剂存在的问题,将天然酶与金属纳米颗粒结合制备复合制剂是一种新型策略。由于天然酶是两亲性生物大分子,表面含有还原性氨基酸残基,可以作为模板和还原剂与金属离子结合,生成超小粒径的金属颗粒,超小粒径的金属颗粒具有更高的细胞毒性,提高了其抗菌活性。同时,酶也可以破坏细菌的细胞结构,有助于金属颗粒进入细菌内部,实现酶与金属的协同抗菌作用。酶和金属的协同抗菌作用可以降低金属用量,从而减少金属系抗菌剂使用过程中的可能毒性。然而,金属离子与酶分子的直接结合可能会影响酶的活性,带来了酶-金属纳米复合制剂制备的难题。酶-金属纳米复合制剂如何实现高效、协同杀菌的机制也仍未研究清楚。因此,针对这一领域最新进展,本综述首先介绍了酶-金属纳米复合制剂在生物传感器、催化、抗菌和癌症治疗等领域的应用研究,然后总结了酶-金属纳米复合制剂的制备新方法,最后讨论了最新研究发现的酶-金属纳米复合制剂的协同抗菌机制。
酶-金属纳米复合制剂的应用
酶具有良好的立体选择性和高效的催化活性,被广泛应用于工业催化、食品生产、药品合成和医学检测等方面。金属纳米颗粒具有独特的催化、光学和电学特性,将酶与金属纳米颗粒结合可以扩展酶催化的应用领域。如图1所示,酶-金属纳米复合制剂在生物传感器、催化、抗菌和癌症治疗等方面的应用探索。在生物传感器中,酶与电极之间的电子传递效率是影响传感器灵敏度的关键因素。Holland等人在葡萄糖氧化酶活性位点附近引入巯基,利用巯基与马来酰亚胺能够特异性结合的特点,将修饰了马来酰亚胺的金纳米颗粒与葡萄糖氧化酶结合,构建了葡萄糖氧化酶-金纳米颗粒(GOx-Au)复合电极(图1a)。结合的金纳米颗粒提高了电子传递效率,从而提高了生物传感器的检测灵敏度。化学酶法动态动力学拆分是一种典型的酶-金属级联催化反应,它由酶催化的动力学拆分反应和金属催化的剩余对映异构体外消旋化反应共同构成,能够有效克服传统酶法动力学拆分最高理论转化率为 50%的限制,在手性化合物的制备中具有重要的应用前景。如图1b所示,戈钧教授课题组在酶-高分子结合物中合成了钯团簇,构建脂肪酶-钯复合催化剂,对动态动力学拆分反应具有很高的效率。图1c描述了酶-金属复合物通过破坏细胞结构、产生活性氧使细菌代谢异常,达到杀菌的效果。施剑林院士课题组展示了一种用于癌症治疗的可生物降解纳米催化剂(图1d)。纳米催化剂由葡萄糖氧化酶和Fe3O4纳米颗粒组成,其中葡萄糖氧化酶消耗肿瘤细胞中的葡萄糖,并产生过氧化氢。Fe3O4纳米颗粒催化过氧化氢发生Fenton反应,产生羟基自由基,引起肿瘤细胞的死亡。
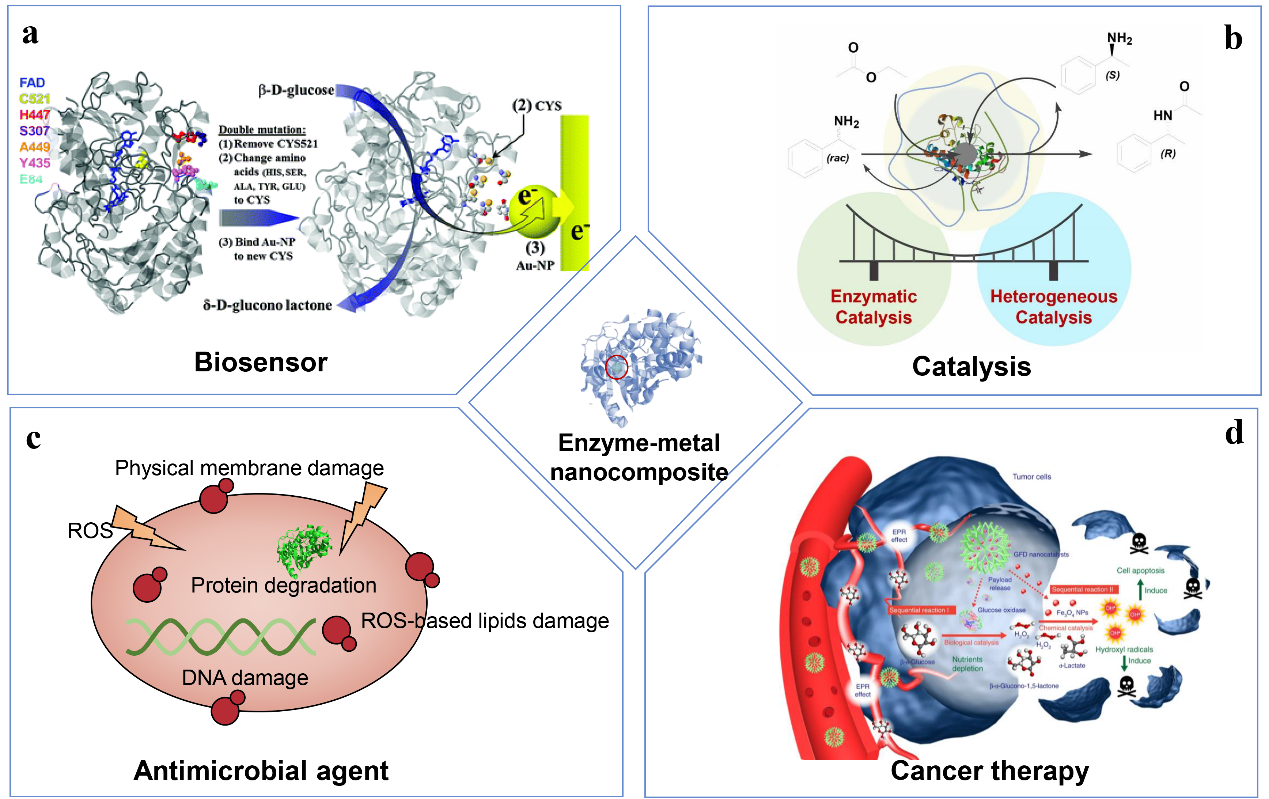
图1 酶-金属纳米复合制剂在生物传感器、催化、抗菌和癌症治疗等方面的应用探索
酶-金属纳米复合制剂的制备
直接将金属颗粒和酶组合是制备酶-金属纳米复合制剂最简单的方法。但是,酶通常在温和的条件下(例如中性pH,水溶液以及室温)发挥作用,酶与金属离子结合时,其活性也可能受到影响,带来了酶-金属纳米复合制剂制备的难题。构建酶-金属纳米复合制剂的关键是如何实现酶与金属二者的适配。
酶-金属纳米复合制剂的常用制备方法主要有两种:酶-金属共固定化和以酶分子为载体的原位还原。共固定化常用载体包括无机材料载体(例如介孔二氧化硅)、金属-有机骨架材料以及聚合物材料等。在以酶分子作为载体的原位还原方法中,酶作为还原剂和稳定剂,金属纳米颗粒在酶分子表面原位生成。
酶-金属共固定化是将酶和金属纳米颗粒负载在同一载体上。其固定化过程分为酶固定化和金属纳米颗粒固定化两个步骤。其中,酶固定化的主要方法有物理吸附、共价结合和自组装,金属颗粒固定化主要是将预先合成的纳米颗粒与载体结合,或者在载体上原位合成金属纳米颗粒。酶-金属共固定化在级联反应中优势明显,将酶与金属纳米颗粒结合在一起,可缩短酶活性位点与金属活性位点间的距离,提高中间产物在活性位点附近的局部浓度,从而增强了级联反应的总催化效率。例如,Bäckvall课题组将脂肪酶和钯纳米颗粒共同固定在介孔二氧化硅中,具体实验中,先在二氧化硅表面修饰氨基,钯离子通过与氨基配位结合在介孔内部,然后被硼氢化钠还原成钯纳米颗粒。随后,经戊二醛修饰过的脂肪酶与二氧化硅介孔中未与钯结合的氨基结合,从而也将脂肪酶固定在二氧化硅介孔中,该复合催化剂催化1-苯乙胺的动态动力学拆分反应,收率高达99%(图2a)。金属-有机骨架材料具有结构柔性且易调节的优点,可用于酶-金属纳米复合制剂的构建。Hou等人构建了mZIF-8@GOx比色传感器应用于葡萄糖的快速检测(图2b),具体实验中,采用共沉淀法将具有过氧化氢酶活性的纳米颗粒Fe3O4与葡萄糖氧化酶(GOx)包埋于金属-有机骨架材料中,制备了磁性mZIF-8@GOx。该复合传感器具有高效、灵敏、稳定性高的优点。牛血清白蛋白(BSA)表面含有酪氨酸残基,可以制备还原氧化石墨烯(RGO)。以合成的BSA/RGO为模板进一步吸附预合成的金属纳米颗粒,构建了共固定在还原氧化石墨烯上的酶-金属纳米复合制剂。
酶分子是一种两亲性生物大分子,并且表面含有带电或还原性氨基酸残基,可以将酶作为模板或还原剂通过静电作用与金属离子结合并将金属离子原位还原制备金属纳米颗粒。Palomo课题组开发出了一种在温和条件下合成酶-金属纳米复合制剂的方法,并提出了金属颗粒在酶表面生长的机理:1)金属离子快速吸附在酶分子上;2)在酶表面的还原性氨基酸残基和辅助还原剂的作用下,金属离子被酶原位还原成金属纳米颗粒。此方法合成的酶-金属复合催化剂可应用在非均相催化中,并重复使用多次(图2c)。Avnir课题组提出了一种将酶包埋在金属颗粒中的方案并探索了包埋的机理。首先,AuCl3OH-与酶表面带正电的氨基酸残基(如赖氨酸、精氨酸残基)结合并达到吸附平衡。然后,在还原剂作用下,吸附在酶表面和溶液中的金离子被还原成金原子,同时,一部分吸附在蛋白上的金原子脱落,在溶液中继续生长形成金核,进一步与酶结合。在蛋白表面的金原子也成核,随着金离子不断被还原,金核不断长大。金离子的还原和生长与酶的吸附-脱附一直在进行,当酶在金颗粒表面的脱附速度大于金颗粒生长的速度时,酶就会被包在金的体相中。该方法具有一定的普适性,研究人员成功将五种酶分别包埋在金体相中。Buszewski等人用牛乳铁蛋白作为模板和还原剂原位还原制备纳米银,并利用分子动力学和密度泛函理论计算分析了银纳米颗粒在牛乳铁蛋白表面的吸附和扩散机制,证实了银主要与牛乳铁蛋白表面的天冬氨酸残基和谷氨酸残基结合。
此外,酶可以调节金属纳米颗粒的形状并促进其各向异性生长(图2d)。不同的蛋白可以控制合成不同形状的纳米颗粒。以纳米银为例,牛血清白蛋白控制合成三角形纳米银,溶菌酶控制合成球形纳米银。这主要和蛋白表面暴露的氨基酸残基有关,赖氨酸残基数量越多,纳米银越趋向于多边形。Xie等人提到天冬氨酸或谷氨酸残基中的羧基也对金属的各向异性生长起作用。
除了共固定化和原位还原方法之外,利用Pickering乳液或人工膜将酶和金属进行分区固定也是制备酶-金属纳米复合材料的重要方法。
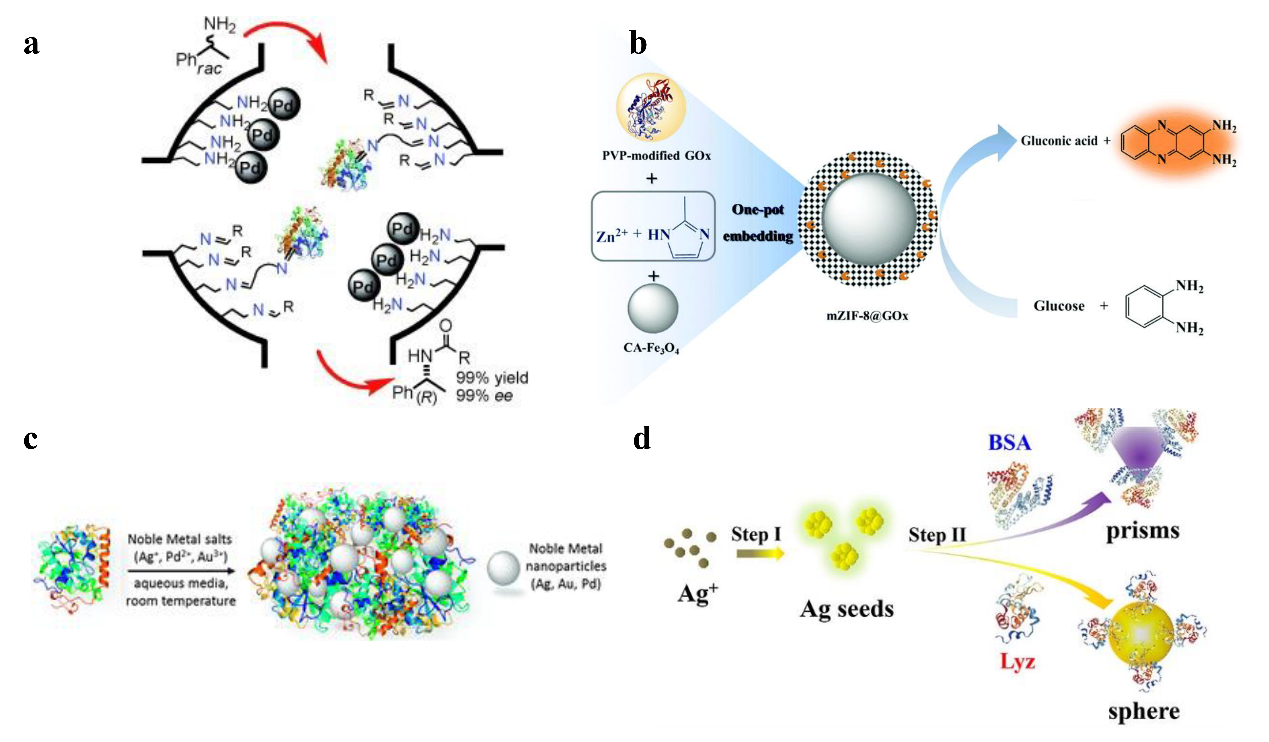
图2 酶-金属纳米复合制剂的制备,酶和金属共固定化在介孔二氧化硅(图2a)或有机金属骨架(图2b)中;金属颗粒原位还原在酶上(图2c-d)
酶-金属纳米复合制剂的抗菌机制
金属纳米粒子具有良好光学、磁学等性能,因而某些金属粒子本身具有杀菌功能。自公元前400年以来,银系抗菌剂一直被用于治疗病原微生物感染,例如,在古希腊时期,医学之父希波克拉底(Hippocrates)就用银来处理伤口炎症。金属纳米颗粒的抗菌机制主要有两条途径:一是破坏细菌的细胞结构,改变细胞膜的通透性,二是干扰细菌代谢,发生氧化应激反应,产生过量的活性氧自由基(ROS),氧化细菌的脂质、蛋白或DNA,从而抑制细菌生长。然而,酶-金属纳米复合制剂的抗菌应用研究报道还很少,其高效的协同抗菌机理尚不明确。
结合文献报道,我们总结了酶-金属纳米复合制剂的多重杀菌机制,主要包括胞外和胞内两方面。在胞外,细菌往往会分泌多糖、蛋白和DNA等聚合物,这些胞外聚合物和细菌一起组成了生物被膜。生物被膜为细菌生长提供了良好的环境,可以抵御宿主免疫系统的攻击和抗生素在生物被膜中的渗透。一些水解酶例如糖苷酶、蛋白水解酶等可以降解这些胞外聚合物,使酶-金属纳米复合制剂更容易渗透到细菌表面。进一步地,当酶-金属纳米复合制剂与细菌表面接触时,细菌细胞壁和细胞膜上的肽聚糖,脂质或蛋白质被水解酶水解或被金属纳米颗粒产生的ROS氧化。当细菌细胞结构发生破损时,酶-金属纳米复合制剂进入细菌细胞内部,在胞内产生过量的ROS,使细菌发生氧化应激反应,细菌内部的蛋白质和DNA失活,从而干扰细菌的生长(图3)。
在酶-金属纳米复合制剂中,酶有三方面的作用。首先,酶作为模板和还原剂,合成超小粒径的金属纳米颗粒,提高金属纳米颗粒的稳定性和抗菌活性;其次,水解酶、蛋白酶和DNA酶等可以破坏致病微生物的生物被膜,有利于金属颗粒与细菌的接触;此外,一些酶如溶菌酶、牛乳铁蛋白本身具有抗菌活性,能够直接干扰细菌的代谢活动,抑制细菌的生长,和金属纳米颗粒协同抗菌。具体的实例如下:DNase I已被证明可以降解细胞外的DNA,使生物被膜变薄,有助于环丙沙星渗透到铜绿假单胞菌上。葡萄糖苷水解酶也被用于降解小鼠伤口中的金黄色葡萄球菌和铜绿假单胞菌的混合生物膜。鱼精蛋白是一种含有大量精氨酸的阳离子蛋白,易穿透生物膜。将修饰后的金纳米颗粒和鱼精蛋白的胍基通过氢键等相互作用结合,可制备具有高稳定性的鱼精蛋白-金纳米复合制剂,与金纳米颗粒相比,鱼精蛋白-金纳米复合制剂对细菌的最低抑菌浓度降低了100倍。水解酶与金属纳米颗粒的结合也可增强对多重耐药菌的杀菌能力。蛋白酶K没有抗菌活性,但是它可以水解细胞外的蛋白质,并引起多重耐药菌细胞壁的理化性质的变化。酶分子还可以调节金属纳米颗粒的表面电荷。蛋白酶K-金纳米复合制剂表面电荷的提高,增强了复合制剂与细菌的静电相互作用,复合制剂表现出较高的杀菌和抗生物膜活性。
有些酶分子本身具有抗菌活性,能够破坏细菌的结构,干扰细菌的代谢。溶菌酶是一种肽聚糖水解酶,它能水解细菌细胞壁,特异性地破坏肽聚糖中N-乙酰胞壁酸和N-乙酰氨基葡萄糖之间的β-1,4糖苷键。革兰氏阳性菌细胞壁含有丰富的肽聚糖,所以对溶菌酶非常敏感。溶菌酶-银纳米复合制剂对耐银的细菌有较强的杀灭作用。但是,溶菌酶-银纳米复合制剂对耐药细菌的抗菌机制还没研究清楚,有假设提出细菌细胞膜上与重金属外排泵相关的蛋白对溶菌酶敏感。牛乳铁蛋白是用于合成血红蛋白和血浆蛋白的最重要的组成部分之一。牛乳铁蛋白可以通过竞争性地与微生物周围的铁离子发生螯合而抑制细菌生长,并且通过其N-末端与细菌表面的脂多糖结合而增加细菌细胞壁通透性。研究显示,牛乳铁蛋白-银纳米复合物对铜绿假单胞菌,金黄色葡萄球菌和耐甲氧西林金黄色葡萄球菌(MRSA)均有明显的抗菌效果。
纳米材料在抗菌上的临床应用研究也在迅速增加,两种银纳米颗粒制剂已经分别处于III期和IV期临床试验中。但是,安全性问题仍然是一个巨大的挑战。酶-金属纳米复合材料的开发可以提高纳米材料的生物相容性并减少纳米颗粒的使用量,有望成为一种新型的治疗细菌感染的方法。
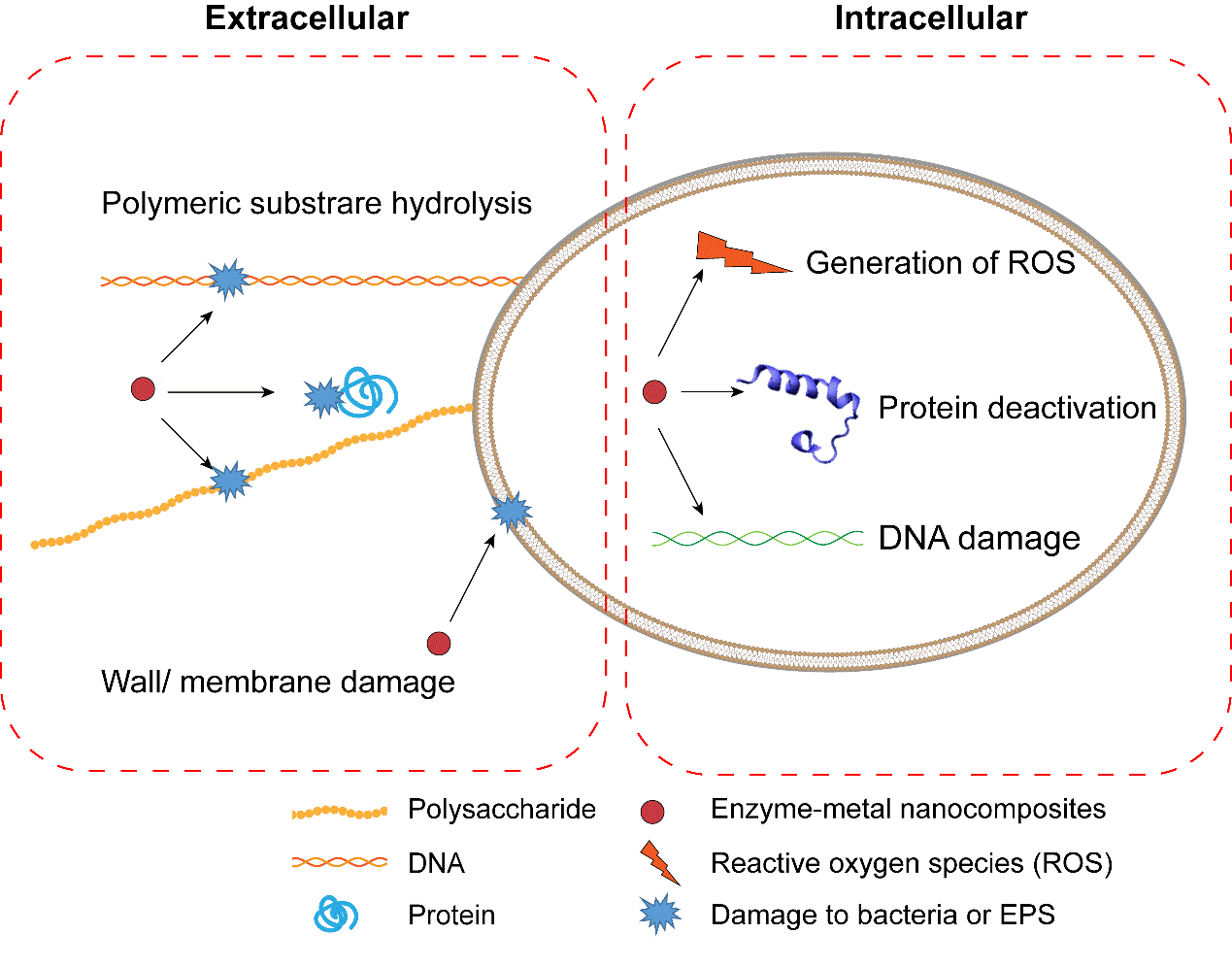
图3 酶-金属纳米复合制剂的抗菌机理
总结与展望
针对酶-金属纳米复合制剂的最新进展,本综述首先介绍了酶-金属纳米复合制剂在生物传感器、催化、抗菌和癌症治疗等领域的应用研究,随后,总结了共固定化和原位还原两种方法合成酶-金属纳米复合制剂,最后讨论了酶-金属纳米复合制剂对病原微生物的协同抗菌机制。针对不同的病原微生物,调节酶的种类和金属纳米颗粒可以定制合成特异性的抗菌剂。酶-金属纳米复合制剂为治疗耐药性病原微生物提供了新思路。
作者介绍

戈钧,清华大学化学工程系长聘教授,博士生导师。分别于 2004 年,2009 年在清华大学化学工程系获得本科和博士学位,2009 年至2012 年在斯坦福大学化学系进行博士后研究,2012 年开始在清华大学化学工程系工作。主要从事酶催化剂工程、生物催化等领域研究。
供稿:原文作者
编辑:《颗粒学报》编辑部
