
MnO2-coated nanodiamond-driven photodynamic therapy for enhanced antitumor effect by addressing hypoxia and glutathione depletion
崔继成,张冬梅*,乔慧,闫泽宇,张文霞,李英奇*
Keywords: Nanodiamond; Photodynamic; Chlorin e6; MnO2; Tumor suppression
DOI: 10.1016/j.partic.2024.05.016
上述成果发表于PARTICUOLOGY (Volume 92),欢迎感兴趣的读者扫描下方二维码或者点击文末“阅读原文”进入ScienceDirect官网阅读、下载!

要点精读
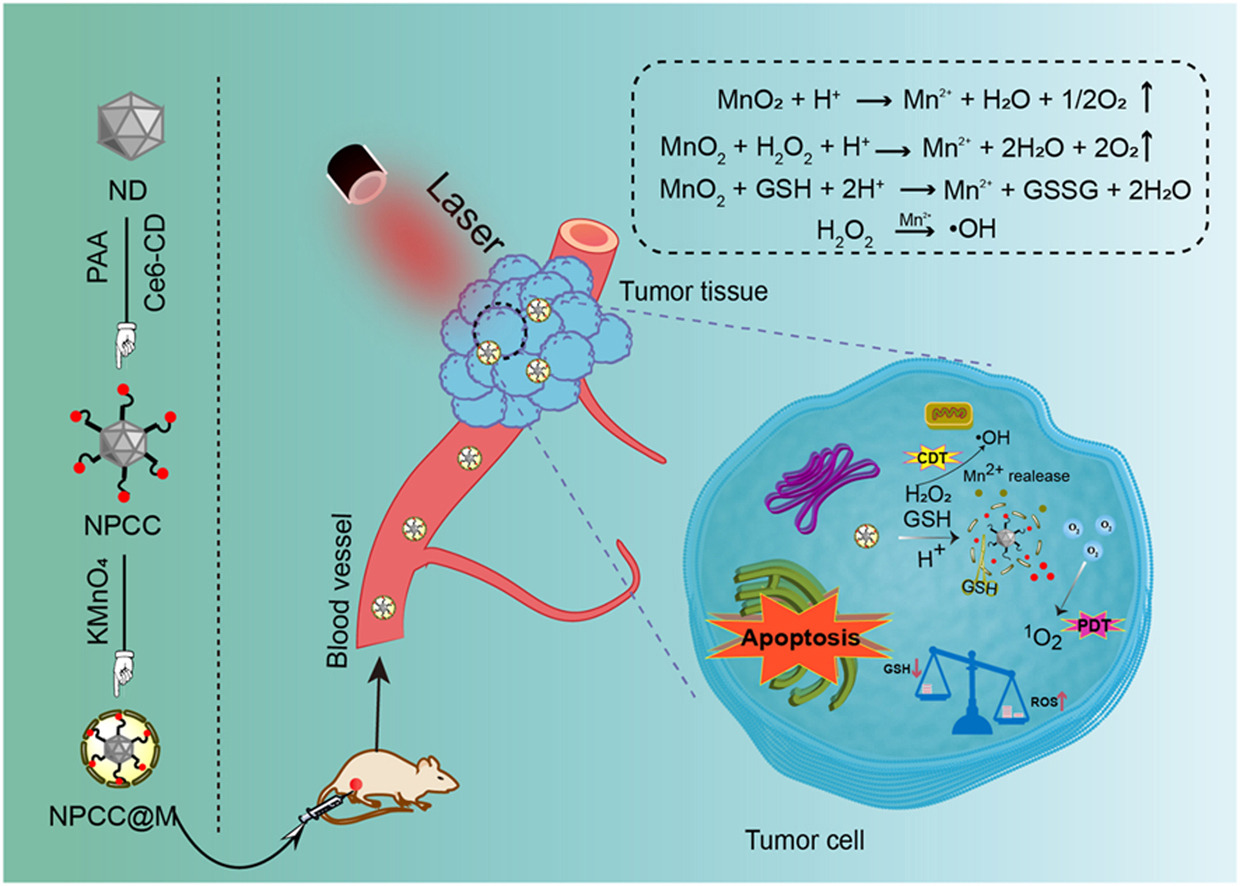
纳米技术的快速发展深刻影响着原有药物的研发模式,目前,基于纳米技术的药物在对抗癌症方面的多种策略已取得显著成效。其中,肿瘤的光动力疗法(PDT)属于一种光驱动的微创治疗方法,因其具有创伤小、毒性低、非侵入性、不易产生抗药性等优势,近年来受到极大关注。但用于光动力治疗的小分子光敏剂多数水溶性较差,对肿瘤无特异选择性,不能在肿瘤部位有效蓄积,导致疗效较低;此外,肿瘤部位缺氧和过表达的还原性谷胱甘肽(GSH)也会导致PDT治疗效果下降。
基于上述背景,山西大学李英奇教授团队选用具有高生物相容性、表面易修饰及载药后具有靶向肿瘤特点的纳米钻石为载体,结合肿瘤微环境特征,基于聚天冬氨酸修饰纳米钻石并通过二硫键将光敏剂二氢卟吩 e6(Ce6)与其共价偶联,进一步通过原位生成的MnO2纳米片包裹,构建了对肿瘤微环境应答的纳米钻石光动力治疗体系,赋予Ce6靶向选择性和增强的光动力治疗。该纳米体系在肿瘤细胞内环境,利用MnO2催化分解H2O2释放氧气解决肿瘤乏氧,在激光照射下提升1O2含量,增强光动力治疗;还原后的Mn2+在肿瘤细胞内发生类芬顿反应产生羟基自由基,诱导化学动力学治疗;同时,过表达的GSH通过参与 MnO2与二硫键反应导致消耗,触发肿瘤细胞内氧化还原稳态失衡。因此,通过联合效应增强了抗肿瘤疗效。经腹腔注射纳米体系展示了良好的生物安全性和高的肿瘤抑制效果。
本工作通过纳米钻石智能系统重塑肿瘤微环境,为增强活性氧(ROS)治疗模式提供了一种高效光动力治疗肿瘤新策略。
亮点总结
(1)纳米钻石颗粒赋予光敏剂Ce6肿瘤靶向性,并增强光动力治疗
(2)MnO2催化肿瘤内源性H2O2产生氧气,缓解肿瘤乏氧,同时还原后的Mn2+诱导化学动力学疗法,协同光动力治疗
(3)肿瘤内还原性的谷胱甘肽通过与MnO2和二硫键的反应重塑氧化还原稳态微环境
作者简介

崔继成,第一作者,山西大学分子科学研究所,博士研究生,无机化学专业,研究方向为生物无机化学。

李英奇,通讯作者,山西大学化学化工学院教授,博士生导师,主要从事纳米材料功能化及其生物成像、靶向抗肿瘤效应等研究。先后主持多项国家和省级项目,在国内外期刊发表论文70余篇,授权国家发明专利15项,转让2项,获山西省科学技术奖励(自然科学)二等奖两项。
供稿:原文作者
编辑:《颗粒学报》编辑部
文章信息
Cui, J., Zhang, D., Qiao, H., Yan, Z., Zhang, W., & Li, Y. (2024). MnO2-coated nanodiamond-driven photodynamic therapy for enhanced antitumor effect by addressing hypoxia and glutathione depletion. Particuology, 92, 305-315. https://doi.org/10.1016/j.partic.2024.05.016.
